文章名:
人类胸腺发育的细胞图谱定义了T细胞全谱系的形成

发表期刊:Science
影响因子:41.0
发表时间:2020.02
文章摘要:
胸腺为T细胞的分化和选择提供了一个培养环境,这一过程由它们与多种胸腺细胞类型的相互作用所协调。我们使用单细胞RNA测序技术创建了人类一生中胸腺的细胞普查,并重建了T细胞分化轨迹和T细胞受体(TCR)重组动力学。使用这种方法,我们原位鉴定并定位了CD8aa+T细胞群、胸腺成纤维细胞亚型和激活的树突状细胞状态。此外,我们揭示了TCR重组和选择的偏差,这归因于基因组位置和谱系承诺的动力学。综上所述,我们的数据提供了人类一生的全面胸腺图谱,并为人类T细胞的发育有了新的见解
。
作者观念:
胸腺T细胞的成熟和选择,在适应性免疫和中枢耐受性的建立中起着重要作用。该器官在生命早期退化,因此导致的T细胞输出的减少与与年龄相关的癌症、感染和自身免疫的发病率有关。来自胎儿肝脏或骨髓的T细胞前体迁移到胸腺中,在那里它们分化为不同类型的成熟T细胞。胸腺微环境协同支持T细胞分化。虽然胸腺上皮细胞(TECs)提供了促进T细胞激活的关键线索,但其他类型的细胞也参与了这一过程,如进行抗原呈递的树突状细胞(DCs),以及支持TEC分化和维持的间充质细胞,在这里,应用scRNA-seq生成了人类胸腺胚胎、胎儿、儿童和成人阶段不同细胞群的全面转录组谱,并将其与详细的TCR库分析相结合,重建T细胞分化过程。
文章方法:
使用在发育、儿童和成年生活中从人类胸腺分离的细胞进行了单细胞RNA测序(scRNA-seq)。我们从儿童和成人个体中取样了15个跨越孕后7-17周的胸腺发育阶段的胚胎和胎儿胸腺,以及9个出生后的胸腺。采用不同的分类方案来增加对代表性不足的细胞群的覆盖率。利用从单细胞转录组中获得的标记基因,我们通过单分子荧光原位杂交(smFISH)对细胞状态进行了空间定位。为了提供人类和小鼠之间的系统比较,我们还生成了出生后小鼠胸腺的单细胞数据,并将其与已存在的小鼠数据集相结合。最后,为了研究人类TCR库的重组和选择中的偏差,我们富集了TCR序列,用于单细胞文库的生成。
使用的软件
:使用cell ranger软件,使用GRCh38人类参考基因组对基于液滴的测序数据进行比对和定量。UMI计数少于2000个和检测到的500个基因的细胞被认为是空液滴,并从数据集中移除。检测到超过7000个基因的细胞被认为是潜在的双链细胞,并从数据集中删除。Smart-seq2测序数据与STAR(版本2.5.1b)对齐,使用STAR索引和与10倍数据相同的参考索引的注释。使用htseq计数(版本0.10.0)计算基因特异性读计数。使用Scanpy(版本1.3.4)Python软件包加载细胞基因计数矩阵并进行下游分析。双叶检测、聚类、注释、批处理对齐、轨迹分析、细胞-细胞交互和曲目库分析使用Scanpy包中的工具执行,并补充了一些自定义代码。
结果:
我们在人类胸腺中鉴定了50多种不同的细胞状态。人类胸腺细胞状态在发育和成年过程中丰度和基因表达谱动态变化。我们鉴定了人类胸腺成纤维细胞和上皮细胞的新亚群,并将它们进行了原位定位。我们通过计算预测了人类T细胞从造血胎儿肝的早期祖细胞到不同成熟T细胞类型的发育轨迹。利用这一轨迹,我们构建了一个驱动T细胞激活决定的假定转录因子的框架。在胸腺非常规T细胞中,我们注意到一个独特的CD8aa+T细胞亚集,以GNG4表达为标志,位于胸腺髓周区域。该亚群高水平表达XCL1,并与XCR1+树突状细胞共定位。对人类和小鼠胸腺细胞的比较显示,这些非常规T细胞类型的基因表达谱不同。最后,我们发现了由重组和多轮选择形成的人类VDJ使用的强烈偏倚,包括CD8+T细胞的TCRaV-J偏倚。
作者结论:
我们对人类一生和跨物种胸腺的单细胞转录组图谱提供了原生组织微环境中T细胞发育的高分辨率普查。人类和小鼠胸腺之间的系统比较突出了人类特异性的细胞状态和基因表达特征。我们详细的胸腺生态位细胞网络将有助于建立体外类器官培养模型,真实地再现人类体内胸腺组织。
只能说,大牛就是大牛啊,他的观点和方法从任何方面都体现出了人家的厉害之处,无论是样品的来源与对照,还是实验的方法和思路,都很好的避免了实验中可能产生的各种误差,在这篇文章中,作者作者的立意直接就说了,为了人类而写下的,这个图谱的绘制成功会很大程度的让我们人的疾病治疗更加方便,我们都知道胸腺细胞是我们人类的主要的免疫器官,尤其是HIV也与胸腺细胞有很大关系,这篇文章有助于我们对胸腺细胞的研究,可以更加清楚的知道胸腺细胞的作用方式,在这篇文章中作者将胸腺细胞进行了分群,分成了40个亚群,包括双阴性(DN)、双阳性(DP)、CD4+单阳性(CD4+)、CD8+单阳性(CD8+)、FOXP3+调节性(Treg)、CD8aa+和gdT细胞。我们还鉴定了其他免疫细胞,包括B细胞、自然杀伤细胞(NK)细胞、先天淋巴样细胞(ILCs)、巨噬细胞、单核细胞和树突状细胞。树突状细胞可进一步分为髓系/常规DC1和DC2和浆细胞样DC(pDC)
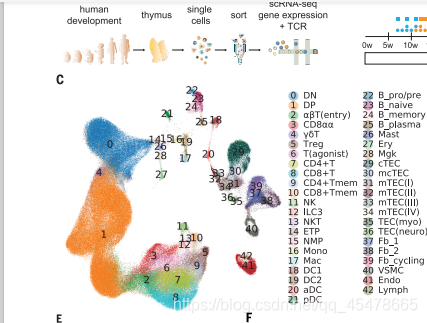
这是大佬的分群图,这个分群很多很密,可以看到不同类型的而细胞含量及相关的关系,与此同时在这个文章中,作者还使用了UMAP分群,这个与TSNE分群一样也是非线性降维,可以更好地对细胞进行分群。
,
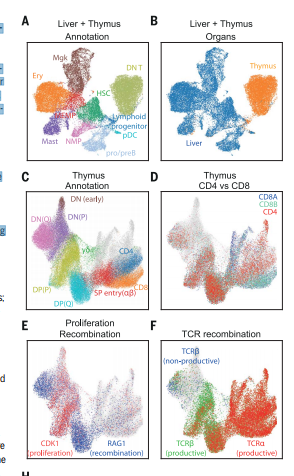
(A)ETP和胎儿肝造血干细胞(造血干细胞)和早期祖细胞的UMAP可视化。NMP,嗜中性粒细胞髓系祖细胞;MEMP,巨核细胞/红细胞/肥大细胞祖细胞。(B)按器官颜色显示相同的UMAP(肝脏为蓝色,胸腺为黄色/红色)。(C)批量校正后发育中的胸腺细胞的UMAP可视化(D-F)相同的UMAP图显示CD4、CD8A和CD8B基因表达(D)、CDK1细胞周期和RAG1重组基因表达(E)、TCRa、生产TCRb和非生产TCRbVDJ基因(F)。(G)显示T细胞分化假时间内差异表达基因的热图。
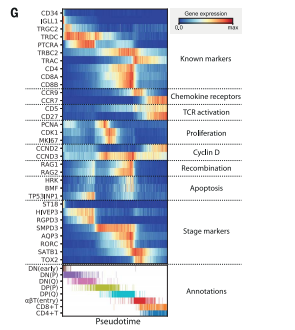
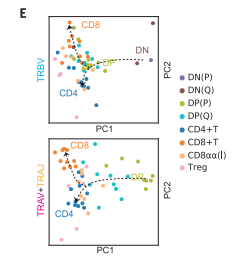
这是细胞轨迹分析图显示了不同T细胞类型中TRBV或TRAV和TRAJ基因的使用模式。箭头表示T细胞的发育顺序。对于TRBV,beta选择有很强的影响,之后CD4+和CD8+库出现分歧。TRAV+TRAJ的发展更加深入,CD4+与CD8和CD8+库逐步分化
作者在文中的讨论我觉得大家也可以看一看:我们结合TCR库信息重建了人类传统和非传统T细胞分化的轨迹,揭示了成熟传统T细胞的TCR库存在偏倚。因为TCR结果偏倚使我们易于对不同的pMHC组合产生反应性,这可能对我们如何应对抗原挑战具有深远的影响。我们对胸腺微环境的分析揭示了构成胸腺的细胞类型的复杂性,以及基质细胞和先天免疫细胞之间相互作用的广度,以协调胸腺发育以支持T细胞分化。我们描述的胸腺细胞和支持细胞之间的细胞间通信网络可用于增强体外培养系统生成T细胞,并将影响未来的T细胞治疗工程策略。
作者的讨论很宏大,最后一句直接就说了影响未来的治疗工程策略,我想既然作者可以发在SCI 这种顶级期刊,那么期刊可能也看出了这个效果的影响,这无疑对我们来说是一个好消息,策略的改变有可能是往好的方向改变,那么对未来的疾病的治疗也会有积极影响。
在这希望作者可以在以后的研究中更加顺利,完成自己的科研,争取对我们人类医疗的技术实现突破。
我所做的所有分析与教程的代码都会在我的个人公众号中,请打开微信搜索“生信学徒”进行关注,欢迎生信的研究人员和同学前来讨论分析。
ps:公众号刚刚建立比较简陋,但是该有的内容都不会少。
————————————————